Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Источник: http://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Содержание
Первое сражение при Булл-Ран

Первое сражение при реке Булл-Ран (англ. First Battle of Bull Run), также Первое сражение при Манассасе) — первое крупное сухопутное сражение Гражданской войны в США. Состоялось 21 июля 1861 года возле Манассаса (штат Виргиния). Федеральная армия под командованием генерала Ирвина Макдауэлла атаковала армию Конфедерации под командованием генералов Джонстона и Борегара, но была остановлена, а затем обращена в бегство. Федеральная армия ставила своей целью захват важного транспортного узла — Манассаса, а армия Борегара заняла оборону на рубеже небольшой реки Булл-Ран. 21 июля Макдауэлл отправил три дивизии в обход левого фланга противника; им удалось атаковать и отбросить несколько бригад конфедератов. Через несколько часов Макдауэлл отправил вперёд две артиллерийские батареи и несколько пехотных полков, но южане встретили их на холме Генри и отбили все атаки. Федеральная армия потеряла в этих боях 11 орудий, и, надеясь их отбить, командование посылало в бой полк за полком, пока не были израсходованы все резервы. Между тем на поле боя подошли свежие бригады армии Юга и заставили отступить последний резерв северян — бригаду Ховарда. Отступление Ховарда инициировало общий отход всей федеральной армии, который превратился в беспорядочное бегство. Южане смогли выделить для преследования всего несколько полков, поэтому им не удалось нанести противнику существенного урона.
Хорошая статья
Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Это интересно: Авария на трубопроводе — описываем развернуто
Из Википедии — свободной энциклопедии
Не следует путать с Hf.
 |
|
 |
|
 |
|
| Систематическое наименование |
фтороводород |
|---|---|
| Хим. формула | HF |
| Состояние | газ или подвижная жидкость |
| Молярная масса | 20,01 г/моль |
| Плотность | 0,99 г/см³ |
| Энергия ионизации | 15,98 ± 0,01 эВ |
| Т. плав. | −83,4 °C |
| Т. кип. | 19,54 °C |
| Кр. точка | 188 |
| Энтальпия образования | −273,3 кДж/моль |
| Давление пара | 783 ± 1 мм рт.ст. |
| pKa | 3,17 |
| Растворимость в воде | 72,47 (20 °C) |
| Рег. номер CAS | 7664-39-3 |
| PubChem | 14917 |
| Рег. номер EINECS | 231-634-8 |
| SMILES |
F |
| InChI |
1S/FH/h1H KRHYYFGTRYWZRS-UHFFFAOYSA-N |
| RTECS | MW7875000 |
| ChEBI | 29228 |
| ChemSpider | 14214 |
| Токсичность | 
ОХ |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
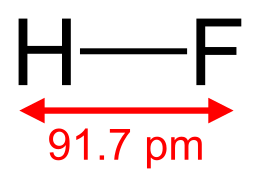
Фтороводоро́д (фтористый водород, гидрофторид, фторид водорода, HF) — бесцветный токсичный газ (при стандартных условиях) с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF.
Источник: http://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Строение молекулы
Молекула фтороводорода сильно полярна, μ = 0,64⋅10−29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
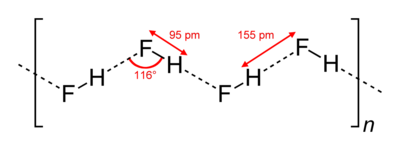
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Источник: http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Хлеб
«Хлеб» (укр. «Хліб») — одна из наиболее известных картин украинской советской художницы Татьяны Яблонской, созданная в 1949 году, за которую ей в 1950 году была присуждена Сталинская премия II степени. Картина также была награждена бронзовой медалью Всемирной выставки 1958 года в Брюсселе, она экспонировалась на многих крупных международных выставках.
В работе над полотном художница использовала наброски, сделанные летом 1948 года в одном из наиболее благополучных колхозов Советской Украины — колхозе имени В. И. Ленина Чемеровецкого района Каменец-Подольской области, в котором в то время было одиннадцать Героев Социалистического Труда. Яблонская была восхищена масштабами сельскохозяйственных работ и людьми, которые там трудились. Советские искусствоведы отмечали, что Яблонская изобразила на своей картине «новых людей», которые могут существовать только в социалистическом государстве. Это настоящие хозяева своей жизни, которые по-новому воспринимают свою жизнь и деятельность. Произведение было задумано и создано художницей как «обобщённый образ радостной, свободной творческой работы». По мнению французского искусствоведа Марка Дюпети, эта картина стала для своего времени программным произведением и образцом украинской реалистической живописи XX столетия.
Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Свойства
Физические свойства
Химические свойства
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5: Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III): (AlF3 — как кислота) (AlF3 — как основание)При условии, если фтороводород в газообразном состоянии: При условии, если фтороводород в виде водного раствора: Kd= 7,2⋅10−4 Kd= 5,1Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все соли плавиковой кислоты ядовиты.
Источник: http://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Это интересно: Водород хлористый (хлороводород)
Изображение дня

Рассвет в деревне Бёрнсте в окрестностях Дюльмена, Северный Рейн-Вестфалия
Из новых материалов
Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Получение
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Источник: http://howlingpixel.com/i-ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Знаете ли вы?



Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Текущие события

Источник: http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4
Количество использованных доноров: 4
Информация по каждому донору:
- http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4: использовано 1 блоков из 10, кол-во символов 1067 (16%)
- http://wiki2.org/ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4: использовано 3 блоков из 10, кол-во символов 2313 (34%)
- http://howlingpixel.com/i-ru/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4: использовано 1 блоков из 10, кол-во символов 533 (8%)
- http://ru.wikipedia.green/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4: использовано 5 блоков из 6, кол-во символов 2929 (43%)






